结果 图2显示了碳酸钠与HCl的滴定曲线。曲线中有两个突然的pH变化。这些对应于以下连续反应: Na 2 CO 3 + HCl - > NaHCO 3 + NaCl(碳酸盐转化为碳酸氢盐) NaHCO 3 + HCl - > CO 2 + H 2 O + NaCl 在该实验中计算的HCl的摩尔浓度为0.95mol / l。
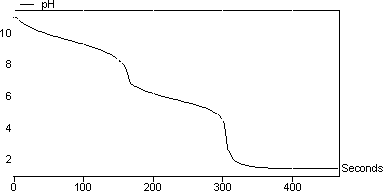 图2:碳酸钠对HCl的滴定曲线
图2:碳酸钠对HCl的滴定曲线
图3显示了反应的滴定曲线: NaOH + HCl→> NaCl + H 2 O. 该反应涉及强酸(HCl)和强碱(NaOH)。您可以注意到pH值从非常高的pH值变为非常低的pH值。在此类反应中,等当点的pH值为7.将光标移动到屏幕上,看到最陡的痕迹发生在pH 7 在该实验中计算的NaOH的摩尔浓度为1.01mol / l。
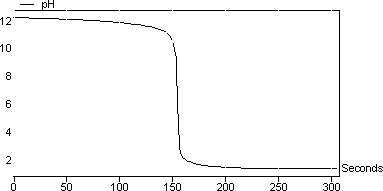 图3:NaOH对HCl的滴定曲线
图3:NaOH对HCl的滴定曲线
图4显示了用HCl滴定发酵粉末期间的pH变化。与碳酸盐实验相反,我们在这里只能看到一个突然的pH步骤,其对应于碳酸氢盐转化为二氧化碳。值得注意的是,图4类似于图2的第二部分。
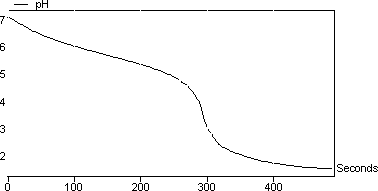 图4:发酵粉对HCl的滴定曲线
图4:发酵粉对HCl的滴定曲线
图5显示了醋对氢氧化钠的滴定曲线。注意,由于添加NaOH,滴定期间溶液的pH增加。 涉及的反应是: CH 3 COOH + NaOH - > CH 3 COO-Na + + H 2 O. 在该实验中计算的醋中乙酸的浓度为5.85%(w / w)
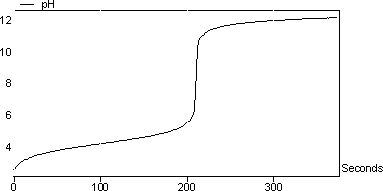 图5:醋对NaOH的滴定曲线
图5:醋对NaOH的滴定曲线
图6与图3相反,其中HCl用NaOH滴定。很明显,在滴定强酸(例如HCl)的情况下,pH跃迁大于用碱滴定弱酸(例如乙酸)时的pH跃变。
 图6:HCl对NaOH的滴定曲线
图6:HCl对NaOH的滴定曲线
问题 1.解释为什么图3和6中等当点的pH值为7,而图5中的pH值为8.86 2.计算图5中的乙酸的pKa。 3.如果用HCl滴定0.1 mol / l碳酸钠和0.1 mol / l碳酸氢钠的混合物,则预测滴定曲线。 4.如果您没有校准流速会发生什么?
进一步研究 1.重复第3部分,用HCl和NaOH的浓度减少10和100倍。研究浓度对pH变化的影响。 2.用H 3 PO 4代替HCl 重复第6部分。(你应该看到一条上升的曲线,其中两个pH值跳跃对应于磷酸的前两个氢原子) 3.绘制所有先前实验的时间的一阶导数(dpH / dt),并在每种情况下找到终点。一阶导数曲线中的终点定义为最大值处的点。可以通过绘制诸如MicroCal Origin之类的程序来获得一阶导数曲线。(样本如图7所示)
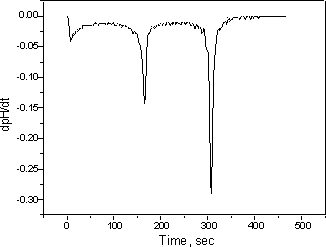 图7:图2的一阶导数,用于更精确的终点位置。
图7:图2的一阶导数,用于更精确的终点位置。
答案 1.图3和图6显示了涉及强酸和强碱的滴定。当量点的溶液含有中性的盐(NaCl),即pH7。而图5显示了弱酸(乙酸)对强碱(NaOH)的滴定。在该等当量点,溶液含有它们的盐(乙酸钠),它是碱性盐,在这种情况下pH值> 7,8.86。 2.可以通过测定半中和时的pH来计算乙酸的pKa。此时pH = pKa(理论值= 4.74,实验值4.6)。 3.第二步将是第一步的两倍。 4.您仍然可以获得滴定曲线,但您无法确定达到等当点所需的滴定剂体积,当然也无法计算未知浓度。
回到实验